Yksilölliset laitetunnisteteknologiat automatisoivat lääkinnällisten tunnisteiden ja viivakoodien lukemisen
Julkaisija DigiKeyn kirjoittajat Pohjois-Amerikassa
2023-10-26
Vuonna 2013 Yhdysvaltain elintarvike- ja lääkevirasto (FDA) otti käyttöön yksilöllisen laitetunnistusjärjestelmän eli UDI-säännön. Säännön tarkoituksena oli parantaa potilasturvallisuutta tarjoamalla yhdenmukainen menetelmä lääkinnällisten laitteiden jäljittämiseen ja tunnistamiseen käyttämällä nykyaikaista dokumentaatiota valmistuksessa, jakelussa ja käyttöpisteissä. Aivan kuten lääkinnällisiä laitteita koskevat vaatimukset Euroopassa tai vastaavat määräykset muissa maissa, Yhdysvaltain UDI-sääntö parantaa raportointitarkkuutta ja helpottaa analysointia takaisinkutsun tai haittatapahtuman sattuessa.
24.9.2023 lähtien FDA valvoo täysimääräisesti kansallisia terveyteen liittyviä tuotekoodeja ja lääkekoodinumeroita laitemerkinnöissä ja pakkauksissa. Kyseisestä päivästä lähtien kaikkien lääkinnällisten tuotteiden merkintöjen on oltava täysin UDI-määräysten mukaisia. Tämä määräys vaikuttaa seuraaviin:
- Luokan 3 elintärkeät tuotteet, kuten sydämentahdistimet ja implantoidut proteesit
- Luokan 2 kohtalaisen kriittiset tuotteet, kuten ruiskut, katetrit ja sulavat ompeleet
- Luokan 1 alemman riskin tuotteet, kuten hammaslanka, leikkaussalivaatteet ja happinaamarit.
Määräyksen täysimääräinen täytäntöönpano tarkoittaa sitä, että jos lääkinnällisessä laitteessa ei ole skannattavaa viivakoodia, sitä ei enää pidetä kelvollisena/käyttökelpoisena tuotteena, vaikka siinä olisi ihmisen luettavissa oleva etiketti ja vaikka tuotteen yleisesti oletetaan olevan useimpien käyttäjien helposti tunnistettavissa. Tämä täysi täytäntöönpano kannustaa lääketiedettä ja sairausvakuutuslaskutusosastoja ottamaan järjestelmän käyttöön kattavasti.
 Kuva 1: Joissakin suoraan kappaleeseen merkittyjen (DPM) viivakoodien todentamiseen tarkoitetuissa kädessä pidettävissä laitteissa on kehittynyt valaistus ja muita ohjelmistoja, jotka löytävät symbolit automaattisesti ja käyvät läpi asetuksia optimoidakseen juuri kyseisen DPM-merkin ja materiaalin lukemisen. Itse asiassa tässä näytettävä LVS-9585 voi todentaa sekä DPM-osia että tulostettuja tarroja, tarjoten kattavan analyysin ja raportoinnin. (Kuvan lähde: Omron Automation)
Kuva 1: Joissakin suoraan kappaleeseen merkittyjen (DPM) viivakoodien todentamiseen tarkoitetuissa kädessä pidettävissä laitteissa on kehittynyt valaistus ja muita ohjelmistoja, jotka löytävät symbolit automaattisesti ja käyvät läpi asetuksia optimoidakseen juuri kyseisen DPM-merkin ja materiaalin lukemisen. Itse asiassa tässä näytettävä LVS-9585 voi todentaa sekä DPM-osia että tulostettuja tarroja, tarjoten kattavan analyysin ja raportoinnin. (Kuvan lähde: Omron Automation)
Hankintayksikkö (tuotemerkin haltija) on vastuussa
Yhdysvalloissa jokaisen lääkinnällisen tuotteen immateriaalioikeuksien omistaja ja kuluttajabrändi ovat vastuussa UDI-koodien tarkkuudesta ja laadusta. Tämä on erityisen tärkeää, koska suuri osa markkinoiden lääkinnällisistä tuotteista valmistetaan sopimuksella ja ulkoistetaan muiden organisaatioiden toimitiloihin. Siksi on hankintaorganisaation vastuulla varmistaa, että sen koko toimitusketju on UDI-vaatimusten mukainen ja tuottaa tarkkoja merkintöjä.
Yksilöllisen laitetunnisteteknologian alkuperä
UDI-tunnisteet ovat staattisia laitetunnisteita. Muutokset pakkauksen sisältämien nimikkeiden määrässä saattavat kuitenkin synnyttää tarpeen uudelle tunnisteelle. Tunnisteita myöntävät tahot määräävät, miten nämä tiedot erotetaan toisistaan. Samalla tavalla myös laitteen pakkaussteriiliyden muuttaminen voi muuttaa laitteen tunnistetta. Laitteen kohdemarkkinoiden (maa, jossa laite myydään), etiketin kielen tai CE-merkinnän muuttaminen voi myös edellyttää muutoksia laitetunnisteeseen.
Ennen UDI-sääntöä lääkinnällisten laitteiden valmistaja saattoi merkitä tuotteen tietyllä osanumerolla. Jälleenmyyjä vaihtoi sitten kyseisen osanumeron, ennen kuin terveyspalvelun tarjoaja tai sairaala vaihtoi sen uudelleen. Koska oli mahdollista, että jokainen taho muutti osanumeroa ennen kuin osa tavoitti potilaan, oli lähes mahdotonta seurata tuotteita, käsitellä takaisinkutsuja, estää väärennöksiä tai tilata tarkkoja varastotäydennyksiä tehokkaasti.
Aiheeseen liittyvää: Robustien jäljitettävyysratkaisujen toteuttaminen
Tällä hetkellä jokaiselle laitteelle annetaan standardoitu ja pysyvä tunniste, eli yksilöllinen laitetunniste (UDI), jotta kaikki tahot voivat tunnistaa laitteen nopeammin ja tarkemmin, mikä lopulta vähentää lääketieteellisiä virheitä. Tämä UDI on aakkosnumeerinen koodi, joka sisältää kaksi avaintietoa:
- Laitteen tunniste
- Tuotantoa koskeva tunniste.
Laitteen tunniste on tietylle laitteelle määrätty staattinen merkintä, jossa ilmoitetaan merkitsijä (yleensä laitteen valmistaja) sekä laitteen tarkka mallinumero. Sen sijaan tuotantoa koskeva tunniste sisältää tietoja, jotka voivat vaihdella, ja suuri osa sen sisältämistä tiedoista on valinnaisia. Näitä voivat olla erä- ja valmistussarjakoodit, sarjanumerot, vanhentumispäivämäärät ja valmistuspäivämäärät. Lyhyesti sanottuna valinnaiset tiedot voivat olla mitä tahansa, mitä valmistaja tai merkitsijä pitää tarpeellisena laitteen jäljittämisen helpottamiseksi.
Jokaisen UDI-merkinnän on esitettävä nämä tiedot kahdessa muodossa:
- Ihmisluettava muoto (vain teksti)
- Koneellisesti luettava muoto (luettavissa viivakoodi- tai RFID-skannerilla).
Jos laitetta voidaan käyttää useampiin lääkinnällisiin tarkoituksiin, UDI on merkittävä suoraan laitteeseen, ei sen pakkaukseen. Sääntö koskee myös laitteita, joita voidaan käyttää useita kertoja.
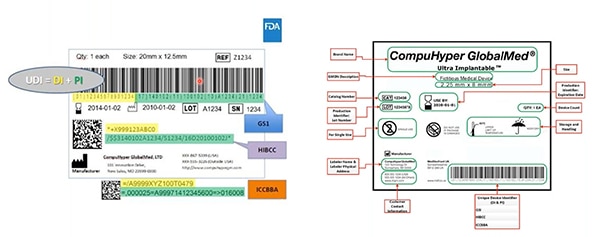 Kuva 2: GS1, HIBCC ja ICCBBA ovat UDI-tunnisteita myöntäviä tahoja, jotka luovat UDI-tunnisteet, määrittävät UDI-merkinnöissä sallitut symbolit, määrittelevät teknologiat, joita voidaan käyttää UDI-tunnisteiden kanssa ja määrittelevät UDI-tunnuksilta vaaditun laadun. Tässä esimerkissä esitetään laitetunniste korostettuna keltaisella ja tuotantoa koskeva tunniste vihreällä. Muita elementtejä ovat ihmisluettava tieto, joka on koodattu myös koneellisesti luettavaan viivakoodiin. (Kuvan lähde: FDA)
Kuva 2: GS1, HIBCC ja ICCBBA ovat UDI-tunnisteita myöntäviä tahoja, jotka luovat UDI-tunnisteet, määrittävät UDI-merkinnöissä sallitut symbolit, määrittelevät teknologiat, joita voidaan käyttää UDI-tunnisteiden kanssa ja määrittelevät UDI-tunnuksilta vaaditun laadun. Tässä esimerkissä esitetään laitetunniste korostettuna keltaisella ja tuotantoa koskeva tunniste vihreällä. Muita elementtejä ovat ihmisluettava tieto, joka on koodattu myös koneellisesti luettavaan viivakoodiin. (Kuvan lähde: FDA)
Kaikki laitteet on rekisteröitävä globaaliin UDI-tietokantaan, jotta jäljitys on mahdollista takaisinkutsun yhteydessä ja jotta kaikilla on pääsy tiettyä laitetta koskeviin tietoihin. FDA:n valtuuttamat tunnisteita myöntävät tahot on valtuutettu luomaan yksilöllisiä tunnisteita laitevalmistajille, jotka sijoittavat niitä tuotteisiinsa.
Aiheeseen liittyvä tekninen raportti: Ajan tasalla pysyminen jäljitettävyydessä
UDI-skannausteknologiat ja -tekniikat
UDI-merkinnät voidaan todentaa monin eri tavoin matkalla valmistuksesta käyttöön.
Tuotantolinjatarkastus tehdään suuriin koneisiin integroiduilla teknologioilla, jotta suuret määrät tuotteita voidaan prosessoida nopeasti ja tarkasti. Toisinaan tähän käytetään edistyneellä ohjelmistolla varustettuja teollisuustason tarratulostimia. Nämä tulostimet pystyvät itse todentamaan UDI-tietojen luettavuuden alan tarkkojen standardien mukaisesti heti, kun ne on luotu tarran tuotantopaikassa. Esimerkiksi Omron Automation V275 ‑todentimet on tarkoitettu käytettäväksi Zebra-lämpötulostimien kanssa FDA-vaatimustenmukaisuutta koskevien ISO 15426 ‑standardin ja tunnisteita myöntävänGS1:n standardien mukaisesti.
Aiheeseen liittyvää: Omronin jäljitettävyysratkaisut
Toisaalla tuotantolinjatodennuksen suorittaa erikoistunut konenäkö automaattisissa tuotantolinjoissa liukuhihnojen vieressä, missä se lukee viivakoodit tarjoten erittäin nopean ja tarkan UDI-merkintöjen todentamisen suurelle valikoimalle tuotteita erittäin nopeilla tuotantolinjoilla. Omron Automationin MicroHAWK-sarja sopii tähän erinomaisesti ja siinä käytetään kehittyneitä antureita sekä pienikokoisia rakenne- ja liitettävyysvaihtoehtoja, mm. Ethernet/IP ja PROFINET.
Aiheeseen liittyvää: Vältä virheellisten merkintöjen tuomaa vastuuta
Sen sijaan tuotannon jälkeinen UDI-todentaminen sopii parhaiten etikettien eränäytteenottoon laadun varmistamiseksi. Sitä käytetään usein näytteiden testaukseen, kun lääkinnälliset laitteet lähtevät laitoksesta tai saapuvat laitokseen, ja se voi täydentää tuotantolinjatodennusta jakelumatkan alussa.
 Kuva 3: Tuotteisiin suoraan merkityt UDI-tunnukset edellyttävät erilaisia todentajia kuin tuotteisiin kiinnitettyihin tarroihin tulostetut UDI-tunnukset. (Kuvan lähde: Omron Automation)
Kuva 3: Tuotteisiin suoraan merkityt UDI-tunnukset edellyttävät erilaisia todentajia kuin tuotteisiin kiinnitettyihin tarroihin tulostetut UDI-tunnukset. (Kuvan lähde: Omron Automation)
Itse asiassa kaikki lääkinnällisen jakelun ja terveydenhuollon toiminnot voivat hyötyä ISO-vaatimusten mukaisten todentajien käytöstä. Katsotaanpa Omronin LVS 95XX ‑sarjan tuotannon jälkeisiä UDI-todentamistuotteita. Niitä käytetään
- lasermerkintäasemissa ja tarratulostimissa, joissa luodaan koodeja
- paikoissa, joissa koodit sijoitetaan tuotteisiin. Nämä paikat voivat olla erillään koodien luontipaikasta
- laadunvalvonta-asemilla, joissa mallit, muotoilu ja muut koodielementit vahvistetaan.
Tuotannon jälkeisen UDI-todentajan variaatioiden määrittäminen
Tiettyyn käyttökohteeseen sopivin tuotannon jälkeinen UDI-todentaja riippuu useista tekijöistä.
Viivakoodin koko: Suuret viivakoodit on usein helpompi skannata lukijoilla, joilla on laaja objektiivin polttovälin ja anturin koon mukaan määrittyvä näkökenttä. Katsotaanpa Omron Automationin LVS-9510 UDI-työpöytälukijoita. Tämä tuotesarja voi lukea sekä lineaariset että 2D-merkinnät. Kullakin viidellä eri versiolla on erikokoinen näkökenttä, joten suunnittelijat voivat valita version, joka on yhteensopiva todennettavien viivakoodien koon kanssa. Kuvien yhdistämistoiminto mahdollistaa näkökentän ylittävien viivakoodien luokittelun.
Lisäksi kaikki LVS-9510-todentajat voivat automaattisesti määrittää symbolit ja aukon, joita tarvitaan koodin arviointiin, sekä tunnistaa ja korostaa ongelmakohtia.
 Kuva 4: ISO-standardien mukaista viivakoodin todentamista helpotetaan laitteilla, joilla voidaan todentaa sekä lineaariset (1D) että kaksiulotteiset (2D) koodit. Jotkin tällaiset laitteet määrittävät symbolit ja aukon, joita tarvitaan koodien arviointiin, sekä tunnistavat ja korostavat ongelmakohtia. Tässä näkyvässä LVS-9510-todentajassa on kuvien yhdistämistoiminto, joka mahdollistaa näkökenttää suurempien viivakoodien luokittelun. (Kuvan lähde: Omron Automation)
Kuva 4: ISO-standardien mukaista viivakoodin todentamista helpotetaan laitteilla, joilla voidaan todentaa sekä lineaariset (1D) että kaksiulotteiset (2D) koodit. Jotkin tällaiset laitteet määrittävät symbolit ja aukon, joita tarvitaan koodien arviointiin, sekä tunnistavat ja korostavat ongelmakohtia. Tässä näkyvässä LVS-9510-todentajassa on kuvien yhdistämistoiminto, joka mahdollistaa näkökenttää suurempien viivakoodien luokittelun. (Kuvan lähde: Omron Automation)
Viivakoodin tyyppi: Skannereiden on luettava viivakoodimuodot, joita tunnuksia myöntävät tahot HIBCC, ICCBBA tai (yleisimmin vuonna 2023) GS1 myöntävät. GS1 määrittää UPC-koodien, lineaaristen viivakoodien ja 2D-datamatriisiviivakoodien koon, muodon ja resoluution.
UDI-merkinnän sijainti: Katsotaanpa lääkinnällisten laitteiden DPM (Direct Part Marking) -suoramerkintää . Nämä merkinnät voivat olla uskomattoman pieniä, varsinkin kun ne ovat kirurgisten instrumenttien ja implantoitavien lääkinnällisten laitteiden tunnisteita. Tällaisia DPM-UDI-tunnuksia voidaan lukea ja todentaa Omronin kädessä pidettävillä LVS-9580- ja LVS-9585-ultra-HD-todentajilla, jotka voivat erikoislinssinsä avulla luokitella suuren määrän DPM-merkintöjä aina 0,05 mm:n kennokokoon saakka. LVS-9580- ja LVS-9585-todentajan sisäiset teollisuustason linssit takaavat tasaisen lukutarkkuuden. Kehittyneimpiä osatekijöitä ovat skannereiden sisällä olevat erittäin hallittavat ja kalibroitavat valaistustekniikat. Useiden näkökenttien lisäksi valaistus mahdollistaa otettujen UDI-kuvien välittömän optimoinnin. Tämä on erityisen tärkeää, koska koodistandardi ei salli jälkikorjauksia eikä kuvankäsittelyä.
Lisätietoja UDI-skanneriohjelmistoista
Todentajalaitteistoa tukevien UDI-ohjelmistojen on esitettävä diagnostiikkatiedot intuitiivisessa muodossa, jotta saavutetaan paras mahdollinen tehokkuus. Tämän ohjelmiston on luokiteltava UDI-koodit ISO-parametrien mukaisesti (ennen muuta luettavuuden vahvistamiseksi), ja sen pitäisi mieluiten myös seurata useiden UDI-skannausten aikana pahenevia ongelmia.
Omron sisällyttää kaikki tarvittavat ohjelmistot kaikkiin UDI-skannauslaitteistoihinsa. Ohjelmistoja päivitetään säännöllisesti, jotta pysytään nopeasti kehittyvien säännösten ja uuden toimialalainsäädännön tahdissa.
Omron-skanneriohjelmiston tärkein tehtävä on koodisyntaksin käsittely. Lyhyesti sanottuna jokaisesta viivakoodista tai 2D-koodista täytyy pystyä tarkasti purkamaan kaikki olennaiset tiedot, mukaan lukien tuotetyyppi, eränumero, määrä soveltuvin osin, vanhentumispäivä, toimitustiedot ja niin edelleen. Tuloksena olevat tietojonot pitää muotoilla määrätyllä tavalla, jotta ne pysyisivät muuttuvien vaatimusten, menetelmien ja lääkinnällisten tuotteiden määränpäiden tahdissa.
Skannerin valmistajan tarjoamat säännölliset ohjelmistopäivitykset takaavat, että loppukäyttäjät pysyvät ajan tasalla, vaikka uusia koodeja julkaistaisiin.
Yhteenveto
Yhdysvaltain armeija pyrki aikoinaan ottamaan käyttöön kokonaisvaltaisen lääketieteen UDI-järjestelmän kaltaisen UID-tuoteseurantajärjestelmän. Sen tarkoituksena oli rajoittaa sotilaskohteiden kadonneisiin, duplikoituihin ja laskemattomiin tarvikkeisiin liittyvää massiivista hukkaa, sisällyttäen kaiken valmistetuista Raytheon-aseista pienen yrityksen johonkin erityistarkoitukseen toimittamiin ohjauspiirilevyihin. Nykyään UID-tunnuksia käytetään vaihtelevasti.
Niin ei tule käymään UDI-tunnuksille.
Mantra, joka ohjaa UDI-tunnuksien käyttöönottoa, on suoraviivainen: merkintä on tuote. Väärä etikettihän voi aiheuttaa tapahtumaketjun, joka tuhlaa hoitohenkilökunnan aikaa ja johtaa lääkinnällisen laitteen heittämiseen pois. Siksi UDI-merkintöjen on oltava näkyvissä kaikissa pakkauskerroksissa, kuten yksikössä itsessään, pakkauksessa, paketissa, laatikossa ja kuormalavatasolla. Steriilipakkausten sisällä olevien steriilien lääkinnällisten laitteiden UDI-merkinnät ovat erityisen tärkeitä, koska pakkauksen rikkominen laitteen tyypin varmistamiseksi ei ole hyväksyttävää.
Koska FDA vaatii UDI-direktiivien täyttä noudattamista 24.9.2023 alkaen, edistykselliset skannaustekniikat lääkinnällisten tuotteiden todentamiseksi ovat ensiarvoisen tärkeitä automaatiovalmistajille sekä heidän palvelemilleen koneenrakentajille ja loppukäyttäjille.
Tällaiset skannerit voivat täyttää FDA:n erittäin tarkat UDI-vaatimukset ja vahvistaa merkinnät monenlaisissa laboratorioissa käytettävissä, lääkinnällisissä ja kliinisissä diagnostiikkalaitteissa. Tuotannon jälkeiset viivakoodin todentajat, maksimoi jäljitettävyys, tuotantolinjan konenäkö, kehittyneet DPM-lukijat.

Disclaimer: The opinions, beliefs, and viewpoints expressed by the various authors and/or forum participants on this website do not necessarily reflect the opinions, beliefs, and viewpoints of DigiKey or official policies of DigiKey.









